بیوپسی کلیه چیست و برای چه منظوری انجام می شود؟
بیوپسی کلیه (Renal Biopsy) چرا، چگونه و چه زمانی انجام میشود؟
نقش بیوپسی در تشخیص نفروپاتیها (اولیه و ثانویه). تفاوت بیوپسی تودهای (Mass) و پارانشیمی (Glomerular / Tubulointerstitial)
بیوپسی کلیه (Renal Biopsy) به عنوان استاندارد طلایی (Gold Standard) در ارزیابی پاتوفیزیولوژیک بیماریهای کلیوی شناخته میشود. این پروسیجر تهاجمی، که مستلزم برداشتن قطعهای بافت کلیوی برای بررسی میکروسکوپی است، نقش محوری در تعیین اتیولوژی، پیشآگهی و استراتژی درمانی بیماران مبتلا به نارسایی حاد یا مزمن کلیه (AKI یا CKD)، سندرمهای نفروتیک و نفریتهای فعال ایفا میکند. عدم وجود یک تست آزمایشگاهی غیرتهاجمی معادل، اهمیت بیوپسی را در کار بالینی روزانه تثبیت کرده است.
اهمیت آسیبشناسی کلیه
بیماریهای کلیه را میتوان به دو دسته اصلی تقسیم کرد: بیماریهای پارانشیمی (Parenchymal Diseases) که ساختارهای عملکردی کلیه (گلومرولها، توبولها، اینترستیسیم و عروق) را درگیر میکنند، و بیماریهای انسدادی یا ساختاری (مانند هیدرونفروز یا تومورها). بیوپسی اساساً برای تشخیص و طبقهبندی نفروپاتیهای پارانشیمی حیاتی است.
- نفروپاتیهای اولیه (Primary Nephropathies):
منشأ بیماری در خود کلیه است و شامل بیماریهایی نظیر گلومرولونفریتهای اولیه (مانند بیماری تغییر مینیمال (MCD)، گلومرولواسکلروز سگمانتال کانونی (FSGS)، نفروپاتی غشایی (MN)، نفروپاتی غشایی پرولیفراتیو (MPGN) و نفروپاتی IgA (برایتز)). - نفروپاتیهای ثانویه (Secondary Nephropathies):
ناشی از بیماریهای سیستمیک هستند که کلیه را درگیر میکنند؛ از جمله: نفروپاتی دیابتی، لوپوس نفریت (LN)، آمیلوئیدوز، واسکولیتها (مانند ANCA-مرتبط واسکولیتها)، و بیماریهای مرتبط با رسوب کریستالها.
تفاوت بیوپسی توده ای و پارانشیمی
ساختار درمانی و هدف بیوپسی بسته به نوع ضایعه متفاوت است:
- بیوپسی پارانشیمی (تشخیصی): هدف، نمونهبرداری از بافت عملکردی کلیه برای ارزیابی التهاب، اسکلروز گلومرولی، آسیب توبولی و فیبروز اینترستیسیل است. این بیوپسی عمدتاً در مواردی که علت نارسایی کلیه ناشناخته است یا نیاز به تعیین فعالیت التهابی برای شروع درمانهای ایمونوساپرسیو وجود دارد، انجام میشود.
- بیوپسی تودهای (Mass Biopsy - هدایتی): زمانی انجام میشود که یک توده (Mass) در کلیه (معمولاً یافته رادیولوژیک، مانند کارسینوم سلول کلیوی (RCC) یا کیست پیچیده) مشهود باشد. هدف، تشخیص خوشخیم یا بدخیم بودن توده است و اغلب تحت هدایت تصویربرداری دقیق (CT یا سونوگرافی) صورت میگیرد تا از درگیری بافت نرمال کلیه پرهیز شود و صرفاً از ضایعه نمونهبرداری گردد. این نوع بیوپسی معمولاً توسط رادیولوژیست مداخلهای انجام میشود.
انواع بیوپسی کلیه و تکنیکهای هدایت
تکنیک انتخابی برای بیوپسی کلیه باید بر اساس شرایط بالینی بیمار، وجود یک طرفه بودن بیماری، وضعیت انعقادی و در دسترس بودن تجهیزات انتخاب شود.
** بیوپسی از راه پوست (Percutaneous Renal Biopsy - PRB)
این رایجترین و استانداردترین روش است.
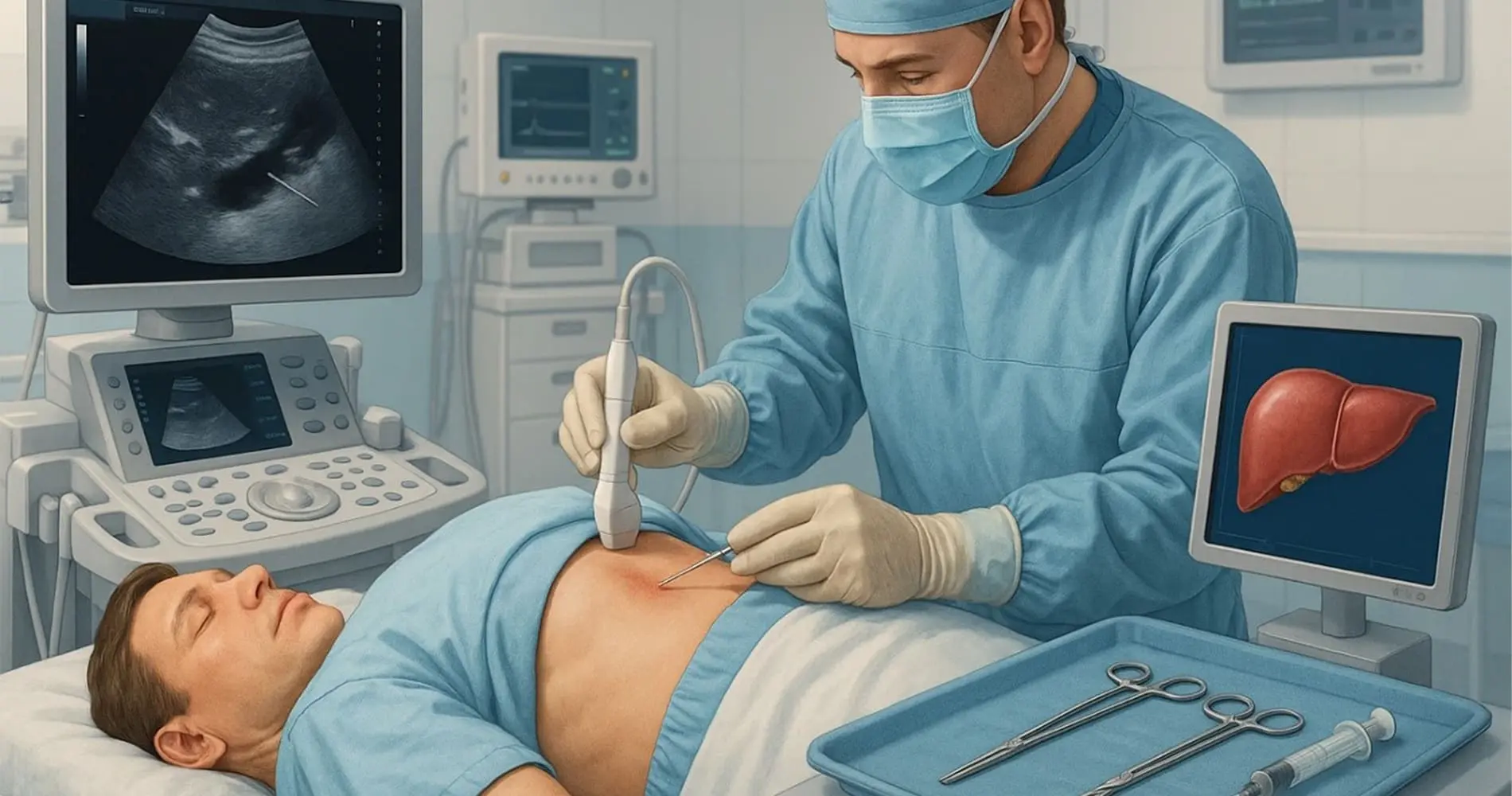
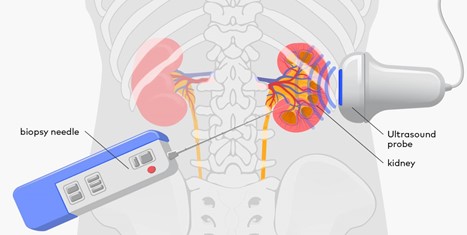
- روششناسی: بیمار در وضعیت دمر (Prone) قرار میگیرد. پس از تعیین محل دقیق کلیه (معمولاً کلیه راست به دلیل فاصله کمتر از کبد) با استفاده از سونوگرافی (Ultrasonography)، یک ناحیه استریل شده و بیحسی موضعی تزریق میشود.
- هدایت تصویربرداری: سونوگرافی هدایت اصلی را فراهم میکند. این روش ایمن، سریع و ارزان است و امکان تصویربرداری بلادرنگ (Real-Time Imaging) از عبور سوزن و جلوگیری از برخورد با عروق بزرگ یا اعضای مجاور را میدهد. در موارد خاصی که سونوگرافی قادر به تشخیص کافی نباشد (مثلاً کلیه بسیار کوچک یا ادماتوز)، هدایت CT ممکن است استفاده شود.
- سوزنها: معمولاً از سوزنهای نمونهبرداری اتوماتیک (مثلاً سوزنهای枪型 - Gun Type) با قطر داخلی حدود 1.5 تا 1.8 میلیمتر استفاده میشود. طول نمونه باید کافی باشد (حداقل ۱.۵ تا ۲ سانتیمتر) تا هم کورتکس و هم بخشهایی از مدولا را شامل شود، که برای تشخیص کافی است (حداقل ۸ تا ۱۰ گلومرول مورد نیاز است).
** بیوپسی از راه ورید ژوگولار (Transjugular Renal Biopsy - TJR)
TJR یک روش جایگزین زمانی است که بیوپسی از راه پوست با خطر بالایی همراه باشد، به ویژه در بیمارانی که اختلالات شدید انعقادی، چاقی مفرط (BMI بالای ۴۰)، هیدرونفروز شدید، یا کلیه غیرقابل دسترس به دلیل فضای کم در شکم دارند.
- روششناسی: یک کاتتر از طریق ورید ژوگولار داخلی (یا فمورال) وارد سیستم وریدی شده و به سمت ورید اجوف تحتانی هدایت میشود. سپس سوزن بیوپسی (اغلب سوزنهای کوچکتر) از طریق کاتتر به داخل ورید کلیوی رانده شده و سوزن به بافت پارانشیم نفوذ میکند.
- مزایا: خطر بسیار پایین خونریزی پس از پروسیجر (به دلیل فشار وریدی پایینتر نسبت به شریان).
- معایب: نمونهبرداری اغلب کیفیت پایینتری دارد، دشوارتر است و نیاز به تجهیزات خاص و مهارت رادیولوژی مداخلهای پیشرفته دارد.
** بیوپسی جراحی (Surgical Biopsy)
این روش امروزه به ندرت انجام میشود و معمولاً محدود به مواردی است که نتایج PRB غیرقابل تفسیر بوده یا نیاز به بیوپسی هدفمند تودههای پیچیده یا برداشتن نمونه بزرگ (Core Biopsy) از یک ناحیه خاص باشد.
- تکنیکها: میتواند لاپاراسکوپی یا باز (Open) باشد. اغلب تحت هدایت مستقیم جراح انجام میشود و امکان کنترل فوری خونریزیهای احتمالی را فراهم میسازد.
موارد اندیکاسیون (نشانهها) برای بیوپسی کلیه
تصمیمگیری برای بیوپسی نیازمند یک ارزیابی بالینی دقیق است که در آن، پتانسیل اطلاعات تشخیصی بر خطر ذاتی پروسیجر ارجحیت یابد.
- پروتئینوری نفروتیک (Nephrotic Syndrome)
- تعریف: وجود پروتئینوری شدید (>3.5 گرم در روز)، هیپوآلبومینی، ادم و هیپرلیپیدمی.
- اندیکاسیون قطعی: در بزرگسالان با سندرم نفروتیک با شروع جدید، اگرچه MCD شایعترین علت اولیه است، بیوپسی برای تفکیک MCD (که کورتیکواستروئیدها پاسخ میدهد) از FSGS و MN (که نیاز به درمانهای قویتر دارند) ضروری است. - نارسایی حاد کلیه با علت ناشناخته (AKI of Unknown Etiology)
- اگر AKI به دلیل سندرم قلبی-کلیوی، شوک یا انسداد قابل توضیح نباشد، بیوپسی برای رد واسکولیتها (مانند گلومرولونفریت حاد نکروزان)، نفریت بینابینی حاد (AIN) ناشی از دارو یا عفونت، یا اختلالات رسوبی مانند کریستالهای اگزالات یا ائوزینوفیلی ضروری است. - هماتوریهای پایدار و نارسایی مزمن کلیه (CRF)
- هماچوری میکروسکوپی/ماکروسکوپی پایدار: به ویژه زمانی که با پروتئینوری همراه باشد، نشاندهنده یک گلومرولونفریت مزمن (مثل IgAN) است.
- CRF با علت نامشخص: اگر CKD پیشرفت سریعی داشته باشد یا الگوی کاهش GFR با یک بیماری شناختهشده سازگار نباشد. - پیگیری پس از پیوند کلیه (Post-Transplant Evaluation)
بیوپسی کلیه پیوندی (از راه پوست یا جراحی) برای اهداف زیر حیاتی است:
- رد پیوند (Rejection): تشخیص رد پیوند سلولی (TCMR) یا رد پیوند آنتیبادی مدیه شده (ABMR) برای شروع درمانهای ضد رد پیوند.
- نفروپاتی عودکننده (Recurrent Glomerular Disease): مانند عود FSGS یا نفروپاتی غشایی در کلیه جدید.
- سندرم اورمیک نفروپاتی (HUS/TTP): تشخیص آسیب ترومبوتیک عروقی. - ضایعات فوکال (Focal Lesions)
بیوپسی هدایت شده برای تودههای کلیوی که مشکوک به بدخیمی هستند و بیمار کاندیدای جراحی نیست یا نیاز به تعیین گرید تومور قبل از عمل است.
فرآیند آمادهسازی و ارزیابی ریسک
مدیریت ریسک پیش از بیوپسی یک اصل مدیریتی حیاتی در پزشکی مداخلهای است. هدف، به حداقل رساندن احتمال خونریزی ماژور است.
* کنترل عوامل انعقادی
- آزمایشهای اولیه: زمان پروترومبین (PT) و نسبت نرمال شده بینالمللی (INR) و زمان ترومبوپلاستین نسبی فعال شده (aPTT) باید به دقت ارزیابی شوند. INR باید کمتر از 1.5 باشد.
- داروهای ضد انعقاد و ضد پلاکت: قطع داروهایی مانند آسپرین، کلوپیدوگرل، دیپیریدامول باید حداقل ۷ تا ۱۰ روز قبل از پروسیجر صورت پذیرد. در مورد وارفارین، INR باید با حداقل پنج روز قطع دارو به محدوده درمانی استاندارد بازگردانده شود و گاهی نیاز به پل زدن با هپارین کوتاهمدت (Heparin Bridging) است.
* کنترل فشار خون (BP Control)
- بیماران باید در زمان پروسیجر فشار خون کنترل شدهای داشته باشند. فشار خون سیستولیک بالاتر از $160 \text{ mmHg}$ یا دیاستولیک بالاتر از $100 \text{ mmHg}$ ریسک خونریزی را به طور قابل ملاحظهای افزایش میدهد و معمولاً پروسیجر باید به تعویق بیفتد تا BP تنظیم شود.
بیوپسی کلیه در بیماران تحت دیالیز
در بیمارانی که نیاز به بیوپسی دارند و همزمان تحت دیالیز هستند، زمانبندی مهم است. معمولاً دیالیز باید حداقل ۲۴ تا ۴۸ ساعت قبل از بیوپسی انجام شود تا اثر ضدانعقاد هپارین کاهش یابد.
نحوه انجام بیوپسی کلیه
پروتکلهای استاندارد شده برای حفظ حداکثر کارایی و ایمنی ضروری است.
موقعیت بیمار و آمادهسازی
- پوزیشن: بیمار معمولاً در وضعیت دمر (Prone) قرار میگیرد. در این حالت، کلیه راست به دلیل قرارگیری کبد در سمت راست، کمی برجستهتر است. بالشهای بزرگ زیر شکم و لگن قرار داده میشوند تا شکاف بین دندهها و استخوان لگن افزایش یافته و حرکت دیافراگم کاهش یابد.
- نظارت: مانیتورینگ مداوم ECG، فشار خون و اشباع اکسیژن الزامی است.
- بیحسی موضعی: استفاده از لیدوکائین ۲٪. تزریق باید در سه لایه انجام شود: پوست، بافت زیرجلدی و کپسول پاراورتبرال/پریرنال. بیحس کردن کپسول کلیه (که حاوی اعصاب است) برای کاهش درد حیاتی است.
تکنیکهای نمونهبرداری و سوزنگذاری
- تکنیک سونوگرافی: از مبدل محدب (Convex Probe) با فرکانس پایینتر استفاده میشود. پس از شناسایی ناحیه ورود (معمولاً بین دندههای ۱۱ و ۱۲ یا ۱۲ و ۱ بعلت فاصله بیشتر از اعضای شکمی)، مسیر سوزن به سمت پارانشیم کلیه، با زاویهای مایل به پایین، تعیین میشود. هدف، ورود به کورتکس خارجی است.
- استفاده از گانهای اتوماتیک: سوزن باید با سرعت بالا و تنها در یک مرحله وارد شود. در سیستمهای اتوماتیک، ماشه رها شده و سوزن نمونهبردار (Inner Stylet) به سرعت خارج میشود تا بافت گیر بیفتد.
- نکات فنی برای کورتیکال در مقابل مدولاری:
- نمونهبرداری باید ترجیحاً از ناحیه قشر (Cortex) انجام شود، زیرا حاوی گلومرولها است که مرکز اصلی آسیبهای پاتولوژیک هستند.
- نمونهبرداری صرفاً از مدولا (که غنی از لولهها است) برای تشخیص گلومرولونفریتها ناکافی است.
- نمونهبرداری باید از حاشیه خارجی کورتکس (Peripheral Cortex) انجام شود تا از آسیب رساندن به سینوس رنال، لگنچه و عروق اصلی اجتناب شود. - تعداد نمونهها: حداقل ۲ تا ۳ کور (Core) با طول مناسب توصیه میشود تا احتمال نمونهبرداری ناکافی (Insufficient Biopsy) کاهش یابد.
عوارض احتمالی و مدیریت پس از بیوپسی کلیه
با وجود پیشرفت تکنیکها، بیوپسی کلیه همچنان با ریسکهایی همراه است که نیاز به آمادگی برای مدیریت فوری آنها دارد.
خونریزی (Hemorrhage)
خطرناکترین عارضه، خونریزی است که میتواند منجر به تشکیل هماتوم پریرنال یا پارارنال شود.
- خونریزی خفیف (Minor Hemorrhage): رایجترین عارضه است (تا ۲۵٪ موارد)، که معمولاً به صورت هماچوری میکروسکوپی یا ماکروسکوپی خفیف تظاهر میکند و به صورت خود به خود با استراحت بهبود مییابد.
- خونریزی ماژور (Major Hemorrhage): کمتر از ۱ تا ۵ درصد موارد رخ میدهد و نیاز به انتقال خون (Transfusion) دارد. این حالت معمولاً با هماتوم بزرگ، افت هموگلوبین بیش از $2 \text{ g/dL}$، یا درد شدید شکمی/پهلو همراه است.
مدیریت فوری پس از پروسیجر
- استراحت مطلق: بیمار باید حداقل برای ۶ تا ۸ ساعت اول (در مراکز پیشرفته تا ۱۲ ساعت) به صورت کاملاً طاقباز (Supine) استراحت کند.
- پایش پارامترهای حیاتی: اندازهگیری مکرر فشار خون و نبض (هر ۱۵ دقیقه در ساعت اول، سپس هر ۳۰ دقیقه تا ۴ ساعت، و پس از آن هر ساعت).
- پایش آزمایشگاهی: کنترل هموگلوبین و هماتوکریت ۴ تا ۶ ساعت پس از پروسیجر و مجدداً قبل از ترخیص.
- درد: مدیریت درد با مسکنهای غیر-NSAID (مانند استامینوفن).
موارد مراجعه فوری پس از ترخیص
بیمار باید در صورت مشاهده علائم زیر فوراً به مرکز درمانی بازگردد:
- تنگی نفس یا درد قفسه سینه (که میتواند نشاندهنده آمبولی ریوی ناشی از هماتوم بزرگ باشد).
- ادامه هماچوری ماکروسکوپی شدید یا تشکیل لختههای ادراری پس از ۲۴ ساعت.
- افت فشار خون (هیپوتانسیون) یا تاکیکاردی که نشاندهنده خونریزی فعال است.
- درد شدید و مداوم شکمی یا پهلو که با مسکن کنترل نمیشود و ممکن است نشاندهنده رشد سریع هماتوم باشد.
تحلیل نتایج آسیبشناسی: مثلث تشخیصی
نتایج میکروسکوپی حاصل از بیوپسی، بافت کلیه را در سه سطح ارزیابی میکنند که یک رویکرد سهگانه تشخیصی را فراهم میآورد:
** میکروسکوپ نوری (Light Microscopy - LM)
LM ارزیابی مورفولوژی سلولی، ساختار گلومرولی و توزیع ضایعات را فراهم میکند.
- ارزیابی گلومرولها: مشاهده افزایش سلولیت (Hypercellularity)، ادم مزانژیال، ضخیم شدن دیواره مویرگی (Thickening)، هیالینوز، اسکلروز کامل گلومرولی (Global Sclerosis) یا فوکال سگمنتال (Segmental Sclerosis).
- ارزیابی توبولها و اینترستیسیم: شناسایی وجود التهاب سلولهای التهابی (مانند لنفوسیتها، ائوزینوفیلها) که شاخص نفریت بینابینی است، ارزیابی میزان نکروز توبولی، و تعیین میزان فیبروز اینترستیسیل (که پیشبینیکننده پاسخ به درمان و پیشرفت CKD است).
** ایمونوفلورسانس (Immunofluorescence - IF)
IF برای شناسایی وجود و توزیع رسوبات ایمنی در دیوارههای گلومرولی یا مزانژیوم ضروری است.
- الگوی خطی (Linear Pattern): نشاندهنده رسوب آنتیبادی در امتداد غشای پایه گلومرولی (مانند گلومرولونفریت تغییر مینیمال یا تغییرات اولیه در نفریت تغییر شکل دهنده).
- الگوی دانه دانه/گرانولار (Granular Pattern): نشاندهنده رسوب کمپلکسهای ایمنی (IgG، IgA، IgM و/یا اجزای مکمل C3 و C1q). این الگو در بیماریهای التهابی مانند IgAN، لوپوس نفریت و MPGN دیده میشود.
** میکروسکوپ الکترونی (Electron Microscopy - EM)
EM ارزیابی اولترا استراکچری فراهم میکند و برای تشخیص دقیقتر در بیماریهای با ضایعات ظریف حیاتی است.
- بیماری تغییر مینیمال (MCD): مشخصه اصلی، زوال و محو شدن پودوسیتها (Foot Process Effacement) در سطح زیرین غشای پایه است.
- نفروپاتی غشایی (MN): مشاهده رسوبات الکتروندانسیته (Electron-dense deposits) در زیر اپیتلیوم (زیر غشای پایه).
- MPGN نوع ۱ و ۳: مشاهده رسوبات در زیر اندوتلیوم یا داخل دیواره غشای پایه.
اصطلاحات رایج در گزارشدهی
- FSGS (Focal Segmental Glomerulosclerosis): اسکلروز در برخی گلومرولها و در بخشی از آن گلومرول. اغلب نیاز به درمانهای قوی دارد.
- MN (Membranous Nephropathy): ضخیم شدن غشای پایه گلومرولی با رسوبات زیر اپیتلیال.
- IgAN (IgA Nephropathy): شایعترین گلومرولونفریت اولیه در سطح جهان، با مشخصه رسوب برجسته IgA در مزانژیوم در IF.
- Lupus Nephritis (LN): طبقهبندی کلاس I تا VI بر اساس فعالیت و مزمن بودن ضایعات در LM و IF.
بیوپسی کلیه در یزد
استان یزد به دلیل ویژگیهای جغرافیایی و محیطی خاص، دارای چالشهای منحصر به فردی در زمینه سلامت کلیه است. با در نظر گرفتن پتانسیلهای پزشکی در این منطقه، برجسته کردن امکانات تخصصی در مراکز درمانی یزد برای بیماران نیازمند به بیوپسی، اهمیت استراتژیک دارد.
امکانات مراکز درمانی در یزد
مراکز تخصصی و فوق تخصصی در یزد، مجهز به تجهیزات پیشرفته رادیولوژی مداخلهای و آسیبشناسی، امکان انجام بیوپسیهای کلیه با دقت بالا را فراهم میآورند. این مراکز باید دارای بخشهای مجهز به سونوگرافی داپلر رنگی با رزولوشن بالا، امکانات کنترل انعقادی سریع، و همچنین آزمایشگاه آسیبشناسی مجهز به تکنیکهای سهگانه (LM, IF, EM) باشند. تخصص رادیولوژیستهای مداخلهای در انجام TJR و PRB تحت هدایت تصویربرداری، عاملی کلیدی در موفقیت این پروسیجرها در بیماران با ریسک بالا است.
تأثیر آب و هوای یزد بر شیوع برخی نفروپاتیها
محیط خشک و گرم یزد میتواند بر روی بروز و پیشرفت برخی بیماریهای کلیوی تأثیر بگذارد:
- سنگ کلیه (Nephrolithiasis): به دلیل تعریق بالا و کاهش حجم ادرار، خطر تشکیل سنگهای اگزالات کلسیم در این منطقه افزایش مییابد. اگرچه سنگ کلیه مستقیماً نیاز به بیوپسی پارانشیمی ندارد، اما تشخیص علل زمینهای (مانند هایپراکسالوری) ممکن است از طریق ارزیابیهای تکمیلی پس از رد سایر علل نارسایی کلیه انجام شود.
- نفروپاتیهای ثانویه و دهیدراتاسیون مزمن: کمآبی مزمن میتواند باعث تغییر در وضعیت همودینامیک کلیه و تشدید آسیبهای موجود (مانند نفروپاتی دیابتی در جمعیت دیابتی استان) شود. در این موارد، بیوپسی برای تعیین شدت آسیب و تعیین بهترین زمان برای شروع درمانهای تعدیلکننده ایمنی حیاتی است.
جمعبندی نهایی و توصیه متخصصان
بیوپسی کلیه یک مداخله کمخطر در صورت انجام توسط تیم مجرب و با استفاده از هدایت دقیق تصویربرداری (عمدتاً سونوگرافی) است. این پروسیجر به عنوان یک ابزار تشخیصی غیرقابل جایگزین، اطلاعات ضروری برای طبقهبندی دقیق نفروپاتیها، تعیین درجه التهاب و فیبروز، و هدایت درمانهای خاص (به ویژه برای بیماریهای ایمونولوژیک و پس از پیوند) فراهم میآورد.
توصیه قاطع: در هر موردی از سندرم نفروتیک با اتیولوژی نامشخص، نارسایی حاد کلیه با اتیولوژی ناشناخته، یا رد پیوند مشکوک، تأخیر در انجام بیوپسی به دلیل ترس از عوارض، میتواند منجر به از دست رفتن پنجره طلایی درمانی و پیشرفت غیرقابل برگشت نارسایی کلیه شود. مدیریت ریسک باید با دقت کنترل شده و پروتکلهای پیش از پروسیجر به صورت مدیریتی و سختگیرانه اجرا گردند. استفاده از تکنیکهای نوین (مانند TJR در موارد خاص) باید در دسترس باشد.